近日,美国FDA接受重新提交的Reproxalap新药申请(NDA)的审查,用于治疗干眼症的体征和症状。FDA指定的处方药用户付费法案(PDUFA)日期为2025年4月2日。在接受NDA审查的同时,Aldeyra宣布扩大与艾伯维公司(AbbVie)的独家选择协议。
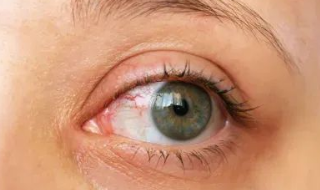
干眼症是由多种原因导致的眼表损伤,患者不仅要忍受诸如干燥感、异物感、疼痛或瘙痒等不适症状,还会因为泪膜不稳定导致视觉障碍,对患者的生活质量甚至心理健康都产生了负面影响。流行病学和临床证据表明,60%-90%的干眼症是由于睑板腺功能障碍导致的蒸发过强型干眼症。
Reproxalap是反应性醛类物质(RASP)的首个小分子调节剂,反应性醛类物质通常在眼部和全身性炎症疾病中升高。
2023年11月,Aldeyra Therapeutics收到了美国FDA的完整回复信,表明在批准决定之前需要额外的疗效数据。最初NDA提交的资料包括来自5个临床试验的疗效和安全性数据,包括3期TRANQUILITY-2研究(ClinicalTrials.gov 标识符:NCT05062330),该研究招募了361名干眼症患者。
作为回应,该公司进行了一项3期、双盲、赋形剂对照的干眼症室激发试验,以评估reproxalap 0.25%滴眼液在干眼症患者中的疗效。该研究(ClinicalTrials.gov标识符:NCT06493604)包括132名患者,他们被随机分配接受reproxalap(n=66)或赋形剂(n=66)。
研究结果显示,对于眼部不适的主要终点,reproxalap在统计学上优于赋形剂,使用0至100的视觉模拟量表进行测量,其中“0”表示无不适,“100”表示在第1次和第3次就诊时干眼症室内超过100分钟的最大不适(P = .004)。最常见的不良事件是滴注部位不适。
在干眼症患者中,reproxalap是第一种具有关键数据支持其在减轻症状方面具有急性和慢性活性的试验药物,也是第一种具有关键数据支持其在减轻眼部发红方面具有急性活性的长期给药试验药物。
详情用药请扫描下方二维码,获取更多药品说明书、药品价格、药品副作用、服用方法等资讯。